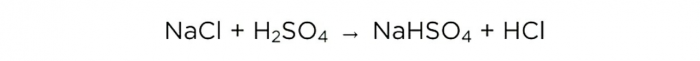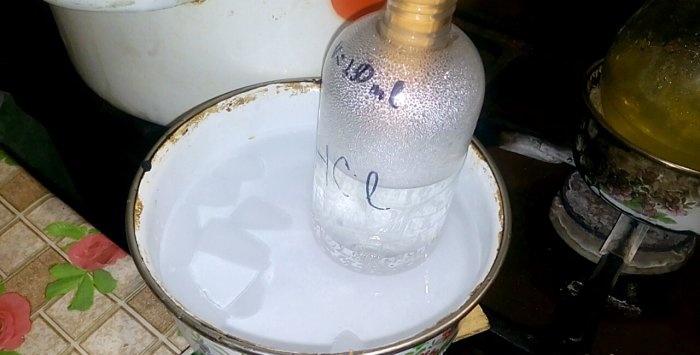15. yüzyılda ilk kez hidroklorik asit alan simyacılar buna “spiritus salis”, “tuzdan gelen ruh” dedi. Bu asit o zamanlar büyülü özelliklere sahipti: kağıda, erimiş metallere, zehirlenmiş insanlara zarar verdi. Bu özellikler onunla bugüne kadar kalmıştır, ancak şimdi bu asit yeterince çalışılmıştır ve burada sihir yoktur.
Hidroklorik asit (HC1) güçlü bir monobazik asittir, saf haliyle berrak bir sıvıdır. Maksimum% 38 konsantrasyonunda, havada “sigara içiyor”. Bunun yarısı kadar konsantrasyonda bir asit alacağız.
Öyleyse başlayalım.
Güvenlik önlemleri
Dikkat, toksik maddelerle çalış!
Tüm deneyler iyi havalandırılan bir odada veya bir davlumbaz altında yapılmalıdır. Koruyucu gözlükler (mağazada mevcuttur. Mağaza) ve eldivenler (özel kimyasal eldiven bulamazsanız, bulaşık yıkamak için iyi kalitededirler) giydiğinizden emin olun.
Deney yerinde, öngörülmeyen bir durumda asidi nötralize etmek için kabartma tozu bulunmalıdır (karbondioksit ve su serbest kalacaktır).
Metal kaplarda deney yapmak kesinlikle yasaktır.
İhtiyaç olacak
Deney yapmak için ihtiyacımız olacak:
- Aküler için asitli elektrolit (otomobil dükkanında satılır);
- Damıtılmış su (agy);
- Tuz (herhangi bir mutfakta);
- Kabartma tozu (güvenlik önlemlerine bakın).
İhtiyacınız olan bulaşıklardan:
- Cam şişesi;
- Şişeyi yerleştirebileceğiniz kumlu bir gemi;
- 200 ml'lik tek kullanımlık bardaklar;
Isıya dayanıklı bir ampulünüz varsa, onu yakıcının açık alevi altında ısıtabilirsiniz. Ama yine de kumdan tavsiye ederim, bu durumda asidi emer.
Ayrıca, 50 mm çapında bir çift sıhhi tesisat köşesine ve bir brülöre ihtiyacınız olacaktır (benim durumumda, alkol, ancak bir tane gaz kullanmanızı tavsiye ederim).
Aşama 1 - buharlaşma
Akü elektroliti,% 36 en fazla sülfürik asittir (H2SO4). İlk önce, konsantrasyonunu arttırmamız gerekiyor.
Camın içine 200 ml dökün, yani, neredeyse kenarlarına ve camın yarısından biraz daha fazlasını şişeye dökün. Bir marker ile bir marker yapın ve gerisini ekleyin.
Daha verimli bir ısıtma için şişenin etrafına bir folyo reflektör koydum, ancak daha sonra erimeye başladığı için onu çıkardım.
Şimdi şişeyi brülöre koyduk ve önceden ayarlanmış olan işaretin seviyesine, hatta biraz daha düşük bir dereceye kadar buharlaşıyoruz.
Paralel olarak, gazlı bez birkaç kez katlanmış olarak köşeye yerleştirilmiş ve elastik bir bant ile sabitlenmiştir. Doymamış bir soda çözeltisi hazırlıyoruz ve içine gazlı bezle köşeye daldırıyoruz.
Elektrolit kaynamaya başladığında, şişeye bir köşe koyarız, üzerine sıkıca oturur. Gazlı bez ucu açık pencereye gönderilir.
Aniden sülfürik asidin kendisi su ile buharlaşmaya başlarsa bu gereklidir. Şişeyi fazla ısıtmazsanız, bu olmayacak.
Brülör çalışırken:
Brülörümün gücü nispeten küçüktür, bu nedenle buharlaşma yaklaşık bir saat sürdü. Bir gaz yakıcısı veya elektrikli soba bu işlemi büyük ölçüde hızlandırır.
İlk aşama tamamlandıktan sonra, çözeltinin yarısından biraz daha azı, yani yaklaşık% 75 konsantrasyona sahip bir asit içinde balonda kalmalıdır. Doğruluğunu unutma.
Oda sıcaklığına soğumaya bırakın.
Aşama 2 - hesaplamalar
Şimdi konsantre sülfürik asidi elde ettiğimize göre, ana reaksiyonu gerçekleştirebiliriz, şöyle görünür:
Ama önce bazı hesaplamaları yapalım ve sonunda bunları uygulamada olanlar ile karşılaştırdık.
Bu nedenle başlangıçta 1.27 g / cm³ yoğunluğunda 200 ml elektrolit vardı. Sülfürik asit yoğunlukları tablosuna baktığımızda, bu yoğunluğun% 36'lık bir konsantrasyona karşılık geldiğini görüyoruz. Asit hacmini hesaplayın:
200 ml *% 36 = 72 ml - V (H2S04)
Çözeltiyi buharlaştırdıktan sonra, konsantrasyonu ve buna bağlı olarak yoğunluk arttı. Aynı tabloya bakıyoruz ve% 75'lik bir konsantrasyonun 1.67 g / cm³ yoğunluğa karşılık geldiğini görüyoruz.
Asidin akım yoğunluğunu (p) ve hacmini (V) bilerek, kütleyi buluyoruz:
m = p * V;
m (H2S04) = 1.67 gr / cm³ * 72 ml = 120 gr;
m (H2S04) = 1.67 gr / cm³ * 72 ml = 120 gr;
Şimdi okul kimyasından hatırlıyoruz:
m (H2S04) / M (H2S04) = m (NaCl) / M (NaCl) = m (HC1) / M (HC1),
M, maddenin molar kütlesidir.
M, maddenin molar kütlesidir.
H2S04, NaCl ve HCl'nin molar kütleleri sırasıyla 98, 58.5 ve 36.5 g / mol'dür. Şimdi ne kadar tuzun gerekli olduğunu ve ne kadar HCl'nin olacağını öğrenebiliriz.
Yani, 72 g NaCl'ye ihtiyacımız olacak, bu 34 ml, fazladan alın - çeyrek bardak.
Mükemmel ve teoride HCl 44.7 g olacaktır.
HC1 yoğunluk tablosunda bir g / l kolonu vardır. Oradan% 15 - 166.4 g / l konsantrasyon değerini aldık. % 15 HCI elde etmek için gereken su hacmi 44.7 / 166.4-270ml'dir. 200 ml alacağız. Sonuç olarak, teoride% 22 hidroklorik asit elde edeceğim.
Aşama 3 - asit elde etme
İki köşeyi aşağıdaki gibi bağlarız:
Ve bütün yapı şöyle görünecek:
Karşılık gelen asit, HC1 etiketli kaba yoğunlaşacaktır, içindeki su hacmi 200 ml'dir. Ayrıca bu haznedeki mevcut sıvı seviyesini işaretleyin.
Köşeleri kaldırıyoruz ve hesaplamalarda hesaplanan tuz miktarını huni içerisine şişeye döküyoruz.
Çözelti sarıya döner.
Hidroklorik asidin öne çıkması için, brülörü açmanız gerekir. Ama önce, köşeleri şişeye ve alıcı kabına sıkıca tutturuyoruz.
Asidin su içerisinde yoğunlaşması ile “dikey dalgalar” oluşur. Ayrıca, çözelti ısınır ve soğutulması gerekir. Örneğin, aşağıdan buzlu başka bir kap koyabilirsiniz.
Reaksiyon nispeten hızlı bir şekilde ilerler - 20 dakika sonra yangını durdurabilirsiniz. Suda çözünmesi için son çift hidroklorik asit verdik, sonra kabı sıkıca kapattık. Şişe soğuduğunda, kalan çözeltiyi su ile seyreltiriz (yaklaşık bire bir) ve lağımın içine dökeriz.
sonuç
Damar üzerindeki etikete göre ne kadar sıvı eklendiğini belirleriz. Ben ⅙, bu% 17'dir. Bu hidroklorik asidimizin konsantrasyonu. Teoride elde edilen ile karşılaştırın.
% 17 /% 22 x% 100 =% 77 reaksiyon verimidir.
1'e eşit bir çıkış yolu olmadığını unutmamak önemlidir, daima kayıplar vardır. Benim durumumda bu yeterli buharlaşmamış elektrolit değildir. İdeal olarak, sülfürik asit konsantrasyonu% 90-95 olmalıdır.
Elde edilen asit ile metal arasındaki etkileşimi kontrol edin.
Hidrojenin hızlı evrimini gözlemliyoruz. Bu, asidin başka deneyler için uygun olduğu anlamına gelir.
varyasyonlar
Bir şişe olarak, temiz bir cam bira veya soda şişesi kullanabilirsiniz, ancak ısıtmanın mümkün olduğu kadar pürüzsüz olması şartıyla. PVC köşeleri yerine, polipropilen boruları ve daha küçük çaplı köşeleri (şişenize uygun) alabilirsiniz.
Bir kez daha, güvenlik önlemlerini almanızı rica ediyorum. Herkese iyi şanslar!