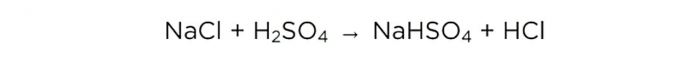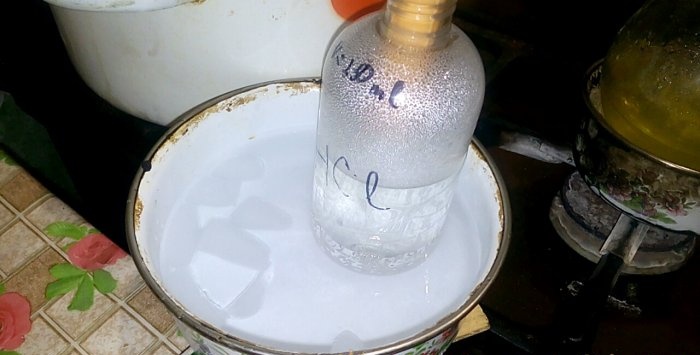Alkemister som först producerade saltsyra på 1400-talet kallade det "spiritus salis", "and från salt." På den tiden hade denna syra magiska egenskaper: den korroderade papper, löste upp metaller och förgiftade människor. Dessa egenskaper finns kvar med det till denna dag, men nu har denna syra studerats tillräckligt, och det finns ingen magi här.
Saltsyra (HCl) är en stark monobasisk syra, i sin rena form är det en transparent vätska. Vid sin maximala koncentration på 38 % "röker" den i luften. Vi kommer att ta emot syra med en koncentration på hälften.
Så låt oss börja.
Säkerhetsåtgärder
Var försiktig när du arbetar med giftiga ämnen!
Alla experiment måste utföras i ett välventilerat rum eller under huva Se till att bära skyddsglasögon (kan köpas i järnaffär) och handskar (om du inte hittar speciella kemikaliehandskar är sådana av god kvalitet lämpliga för att diska).
Bakpulver måste finnas på platsen för experimentet för att neutralisera syran i en oförutsedd situation (detta kommer att frigöra koldioxid och vatten).
Det är strängt förbjudet att utföra experiment i metallbehållare.
Kommer att behöva
För att genomföra experimentet behöver vi:
- Syraelektrolyt för batterier (säljs i bilaffär);
- Destillerat vatten (ibid);
- Bordssalt (finns i alla kök);
- Bakpulver (se säkerhetsföreskrifter).
Från disken du behöver:
- Glaskolv;
- Ett kärl med sand där du kan placera kolven;
- Flera engångsmuggar 200 ml;
Om du har en värmebeständig kolv kan du värma den under öppen låga i en brännare. Men jag rekommenderar ändå att använda sand, i så fall kommer den att absorbera syra.
Du behöver också ett par VVS-vinklar med en diameter på 50 mm och en brännare (i mitt fall alkohol, men jag rekommenderar att du använder en gas).
Steg 1 - indunstning
Elektrolyten för batterier är 36 % svavelsyra (H2SO4). Först måste vi öka dess koncentration.
Häll 200 ml i glaset, det vill säga nästan till brädden, och häll lite mer än halva glaset i kolven. Gör ett märke med en markör och lägg till resten.
Jag placerade en foliereflektor runt kolven för effektivare uppvärmning, men tog senare bort den eftersom den började smälta.
Sätt nu kolven på brännaren och indunsta till nivån för det tidigare inställda märket, till och med lite lägre.
Samtidigt lägger vi gasväv vikt flera gånger på hörnet och fäster den med ett elastiskt band. Förbered en omättad sodalösning och doppa änden av hörnet med gasväv i den.
När elektrolyten börjar koka lägger vi ett hörn på kolven, den sitter tätt på den. Vi riktar gasväven in i det öppna fönstret.
Detta är nödvändigt om svavelsyran själv plötsligt börjar avdunsta tillsammans med vattnet. Om du inte överhettar kolven för mycket kommer detta inte att hända.
Brännare i aktion:
Min brännare har relativt låg effekt, så förångningen tog ungefär en timme.En gasbrännare eller elektrisk spis skulle påskynda denna process avsevärt.
Efter att ha avslutat det första steget bör lite mindre än hälften av lösningen finnas kvar i kolven, det vill säga en syra med en koncentration på cirka 75%. Glöm inte noggrannheten.
Låt den svalna till rumstemperatur.
Steg 2 - beräkningar
Nu när vi har koncentrerad svavelsyra kan vi utföra den grundläggande reaktionen, den ser ut så här:
Men först, låt oss göra några beräkningar, och i slutet kommer vi att jämföra dem med vad som hände i praktiken.
Så till en början hade vi 200 ml elektrolyt med en densitet på 1,27 g/cm³. Om vi tittar på tabellen över densiteter för svavelsyra ser vi att denna densitet motsvarar en koncentration på 36 %. Låt oss beräkna volymen syra:
200ml*36%=72ml - V(H2SO4)
Efter att vi indunstat lösningen ökade dess koncentration, och därför dess densitet. Vi tittar på samma tabell och ser att en koncentration på 75 % motsvarar en densitet på 1,67 g/cm³.
Genom att känna till strömdensiteten (p) och volymen (V) av syran, tar vi reda på massan:
m=p*V;
m(H2SO4)=1,67 g/cm³ * 72 ml=120 g;
m(H2SO4)=1,67 g/cm³ * 72 ml=120 g;
Nu minns vi från skolkemin:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
där M är ämnets molära massa.
där M är ämnets molära massa.
Molmassorna av H2SO4, NaCl och HCl är 98, 58,5 respektive 36,5 g/mol. Nu kan vi ta reda på hur mycket bordssalt som behövs och hur mycket HCl vi kommer att få.
Vi behöver nämligen 72 g NaCl, det är 34 ml, låt oss ta det i överskott - en kvarts glas.
Bra, och HCl kommer i teorin att komma ut till 44,7 g.
HCl-densitetstabellen har en g/l kolumn. Vi tar därifrån värdet för en koncentration på 15% - 166,4 g/l. Volymen vatten som krävs för att erhålla 15 % HCl är 44,7/166,4≈270 ml. Vi tar 200 ml. Som ett resultat kommer jag i teorin att få 22% saltsyra.
Steg 3 - få syra
Vi ansluter de två hörnen enligt följande:
Och hela strukturen kommer att se ut så här:
Motsvarande syra kommer att kondensera till ett kärl märkt HCl; volymen vatten i den är 200 ml. Markera även aktuell vätskenivå på denna behållare.
Vi tar bort hörnen och häller den beräknade mängden salt i kolven genom en tratt.
Lösningen blir gul.
För att saltsyra ska börja släppa måste du slå på brännaren. Men först fäster vi hörnen tätt på kolven och mottagande kärlet.
När syra kondenserar i vatten bildas "vertikala vågor". Dessutom värms lösningen upp och måste kylas. Du kan till exempel placera ett annat kärl med is nedanför.
Reaktionen fortskrider relativt snabbt - 20 minuter, varefter du kan stänga av värmen. Låt de sista ångorna av saltsyra lösas upp i vattnet och förslut sedan kärlet hermetiskt. När kolven har svalnat, späd den återstående lösningen med vatten (ungefär en till en) och häll den i avloppet.
Slutsats
Genom märket på kärlet bestämmer vi hur mycket vätska som har tillsatts. För mig är det ⅙, det vill säga 17 %. Detta är koncentrationen av vår saltsyra. Låt oss jämföra det med det som erhålls i teorin.
17%/22%*100%=77% - reaktionsutbyte.
Det är viktigt att notera att det inte finns någon utgång lika med 1, det finns alltid förluster. I mitt fall är detta en otillräckligt förångad elektrolyt. Helst bör koncentrationen av svavelsyra vara 90-95%.
Låt oss kontrollera den resulterande syran för interaktion med metall.
Vi observerar snabb utveckling av väte. Det betyder att syran är lämplig för ytterligare experiment.
Variationer
Du kan använda en ren glasflaska öl eller läsk som en kolv, men förutsatt att uppvärmningen är så jämn som möjligt. Istället för PVC-hörn kan du ta polypropenrör och hörn med mindre diameter (lämplig för din kolv).
Än en gång uppmanar jag dig att följa säkerhetsföreskrifterna. Glada upplevelser alla!