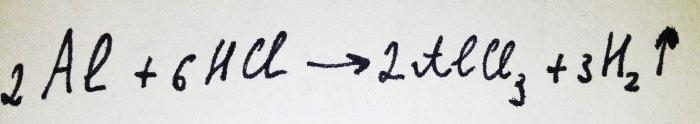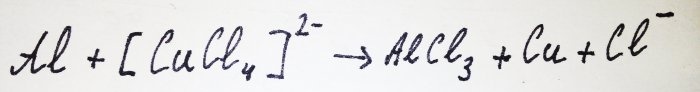Esența sa este că hidrogenul eliberat în timpul reacției arde cu o flacără albastră.
Reactivi
Deci, vom avea nevoie de:
- Concentrația acidului clorhidric 15%;
- Sulfat de cupru;
- Folie de aluminiu.
Vom efectua experimentul într-un borcan de sticlă.
Puteți folosi un vas Petri sau un pahar ca vas. Nu recomand folosirea unui balon, deoarece fluxul de oxigen în interior va fi dificil din cauza gâtului îngust al balonului.
Experiment
Înainte de a efectua acest experiment, vă recomand cu tărie să vă familiarizați cu măsurile de siguranță atunci când lucrați cu acizi.
Turnați o linguriță de vitriol într-un borcan și adăugați 40 ml de acid. Soluția devine verde din cauza formării de tetraclorocuprat cu ion complex de cupru [CuCl4]2-.
Acum nu mai rămâne decât să adăugați folia de aluminiu. Este acoperit cu o peliculă de oxid, dar complexul rezultat îl distruge rapid. Apoi o parte din aluminiu reacţionează cu acidul, ecuaţia pentru această reacţie este:
După cum se poate observa din reacție, se eliberează hidrogen.
Restul aluminiului interacționează cu complexul, înlocuind cuprul din acesta:
Reacțiile apar rapid, eliberând cantități mari de căldură.
Hidrogenul eliberat arde bine în aer, să-i dăm foc.
Fluxul îngust al flăcării este asociat cu caracteristicile gâtului borcanului, iar culoarea albastră bogată îi este dată de ionii de cupru prezenți în soluție.
Să facem același experiment, dar într-un container diferit:
Când tot aluminiul a reacționat, soluția devine gri cu pete de cupru redus la suprafață. Ar trebui diluat cu multă apă și turnat în scurgere.
Au rămas sedimente în partea de jos:
De asemenea, ar trebui să scăpați de el, deoarece după ce ați încercat să filtrați, pe filtru a rămas un precipitat maro deschis și nu poate fi numit cupru.
Concluzie
Și asta încheie acest articol. Această experiență poate fi demonstrată la lecțiile de chimie de la școală. Succes tuturor cu repetarea ta!