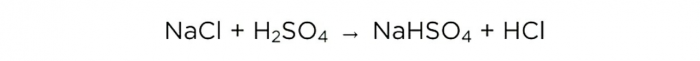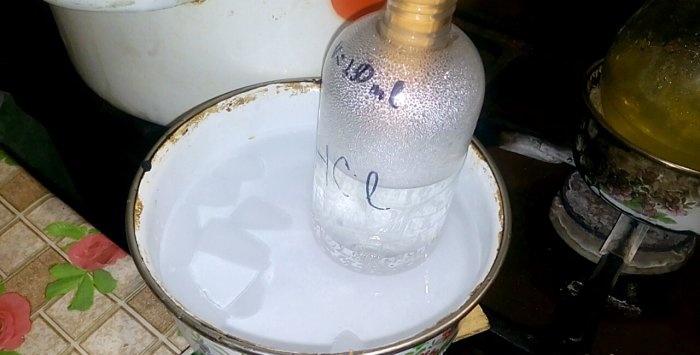Alkymister, som først fikk saltsyre på 1400-tallet, kalte det "spiritus salis", "spirit fra salt." Denne syren hadde magiske egenskaper på den tiden: den korroderte papir, oppløste metaller, forgiftet mennesker. Disse egenskapene har holdt seg hos henne frem til i dag, men nå er denne syren blitt studert tilstrekkelig, og det er ingen magi her.
Saltsyre (HCl) er en sterk monobasic acid, i sin rene form er en klar væske. Ved sin maksimale konsentrasjon på 38% "røyker" den i luften. Vi vil motta en syre med en konsentrasjon halvparten av det.
Så la oss komme i gang.
Forholdsregler
Forsiktig, arbeid med giftige stoffer!
Alle eksperimenter må utføres i et godt ventilert rom eller under avtrekkshette. Sørg for å bruke vernebriller (tilgjengelig i butikken. Butikk) og hansker (hvis du ikke finner spesielle kjemiske hansker, er de god kvalitet for å vaske oppvasken).
På stedet for forsøket må natron være til stede for å nøytralisere syre i en uforutsett situasjon (i dette tilfellet vil karbondioksid og vann frigjøres).
Det er strengt forbudt å gjennomføre et eksperiment i metallbeholdere.
Vil trenge
For å gjennomføre eksperimentet trenger vi:
- Syreelektrolytt for batterier (selges i bilbutikken);
- Destillert vann (ibid.);
- Salt (er i ethvert kjøkken);
- Natron (se sikkerhetstiltak).
Fra oppvasken du trenger:
- Glass kolbe;
- Et kar med sand der du kan plassere kolben;
- Flere engangskopper på 200 ml;
Hvis du har en varmebestandig pære, kan du varme den under åpen ild på brenneren. Men likevel anbefaler jeg det gjennom sand, i så fall absorberer det syre.
Du trenger også et par rørleggerhjørner med en diameter på 50 mm og en brenner (i mitt tilfelle, alkohol, men jeg anbefaler å bruke en gass en).
Fase 1 - fordampning
Batterielektrolytt er mest 36% svovelsyre (H2SO4). Først må vi øke konsentrasjonen.
Hell 200 ml i glasset, det vil si nesten til kantene og hell litt mer enn halvparten av glasset i kolben. Lag en markør med en markør og tilsett resten.
Jeg la en foliereflektor rundt kolben for mer effektiv oppvarming, men fjernet den senere fordi den begynte å smelte.
Nå legger vi kolben på brenneren og fordamper til nivået med det tidligere innstilte merket, enda litt lavere.
Parallelt la vi gasbind foldet flere ganger over hjørnet og fikser det med et elastisk bånd. Vi tilbereder en umettet løsning av brus og dypp i den i enden av hjørnet med gasbind.
Når elektrolytten begynner å koke, legger vi et hjørne på kolben, den sitter tett på den. Gassenden sendes til det åpne vinduet.
Dette er nødvendig hvis svovelsyren plutselig begynner å fordampe med vann. Hvis du ikke overoppheter kolben mye, vil ikke dette skje.
Brenner i aksjon:
Kraften til brenneren min er relativt liten, så fordampning tok omtrent en time. En gassbrenner eller elektrisk komfyr vil øke prosessen kraftig.
Etter at det første trinnet er fullført, skal litt under halvparten av løsningen forbli i kolben, det vil si en syre med en konsentrasjon på ca. 75%. Ikke glem nøyaktigheten.
La det avkjøle til romtemperatur.
Fase 2 - beregninger
Nå som vi har konsentrert svovelsyre, kan vi utføre hovedreaksjonen, ser det ut som følger:
Men først, la oss gjøre noen beregninger, og til slutt sammenligner vi dem med hva som skjedde i praksis.
Så til å begynne med hadde vi 200 ml elektrolytt med en tetthet på 1,27 g / cm³. Når vi ser på tabellen over tettheter av svovelsyre, ser vi at denne tettheten tilsvarer en konsentrasjon på 36%. Beregn volumet av syre:
200 ml * 36% = 72 ml - V (H2SO4)
Etter at vi hadde fordampet løsningen, økte konsentrasjonen, og følgelig tettheten. Vi ser på samme tabell og ser at en konsentrasjon på 75% tilsvarer en tetthet på 1,67 g / cm³.
Når vi kjenner til strømtettheten (p) og volumet (V) av syren, finner vi ut massen:
m = p * V;
m (H2SO4) = 1,67 g / cm3 * 72 ml = 120 g;
m (H2SO4) = 1,67 g / cm3 * 72 ml = 120 g;
Nå fra skolekjemi husker vi:
m (H2SO4) / M (H2SO4) = m (NaCl) / M (NaCl) = m (HCl) / M (HCl),
hvor M er stoffets molmasse.
hvor M er stoffets molmasse.
Molmassene av H2SO4, NaCl og HCl er henholdsvis 98, 58,5 og 36,5 g / mol. Nå kan vi finne ut hvor mye salt som trengs og hvor mye HCl vil være.
Vi trenger nemlig 72 g NaCl, dette er 34 ml, ta i overkant - en kvart kopp.
Utmerket, og HCl i teorien vil være 44,7 g.
Det er en g / l-kolonne i HCl-tetthetstabellen. Vi tar derfra verdien for konsentrasjonen på 15% - 166,4 g / l. Volumet av vann som kreves for å oppnå 15% HC1 er 44,7 / 166,4-270 ml. Vi tar 200 ml. Som et resultat vil jeg i teorien få 22% saltsyre.
Trinn 3 - få syre
Vi kobler de to hjørnene som følger:
Og hele strukturen vil se slik ut:
Den tilsvarende syren vil kondensere inn i karet merket HCl, volumet av vann i den er 200 ml. Merk også gjeldende væskenivå på dette fartøyet.
Vi fjerner hjørnene og hell mengden salt beregnet i beregningene i kolben gjennom trakten.
Løsningen blir gul.
For at saltsyre skal begynne å skille seg ut, må du slå på brenneren. Men først fester vi hjørnene tett til kolben og mottakerfartøyet.
Med kondensering av syre i vann dannes "vertikale bølger". I tillegg varmes løsningen og må avkjøles. For eksempel kan du sette et annet fartøy med is nedenfra.
Reaksjonen fortsetter relativt raskt - 20 minutter, hvoretter du kan slå av brannen. Vi gir de siste parene av saltsyre for å oppløses i vann, hvoretter vi tetter beholderen tett. Når kolben er avkjølt, fortynner vi den gjenværende løsningen der med vann (omtrent en til en) og hell den i kloakken.
resultat
Ved etiketten på fartøyet bestemmer vi hvor mye væske som er tilsatt. Jeg har det ⅙, det er 17%. Dette er konsentrasjonen av saltsyren vår. Sammenlign det med det som er oppnådd i teorien.
17% / 22% * 100% = 77% er reaksjonsutbyttet.
Det er viktig å merke seg at det ikke er noen utvei lik 1, det er alltid tap. I mitt tilfelle er dette ikke fordampet elektrolytt nok. Ideelt sett bør konsentrasjonen av svovelsyre være 90-95%.
Kontroller den resulterende syren for interaksjon med metallet.
Vi observerer den raske utviklingen av hydrogen. Dette betyr at syren er egnet for videre eksperimenter.
variasjoner
Som en kolbe kan du bruke en ren glassflaske øl eller brus, men forutsatt at oppvarmingen er så jevn som mulig. I stedet for PVC hjørner, kan du ta polypropylenrør og hjørner med mindre diameter (egnet for kolben din).
Nok en gang oppfordrer jeg deg til å følge forholdsregler. Lykke til alle sammen!