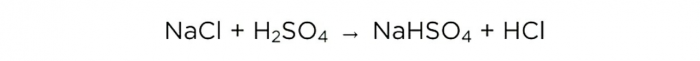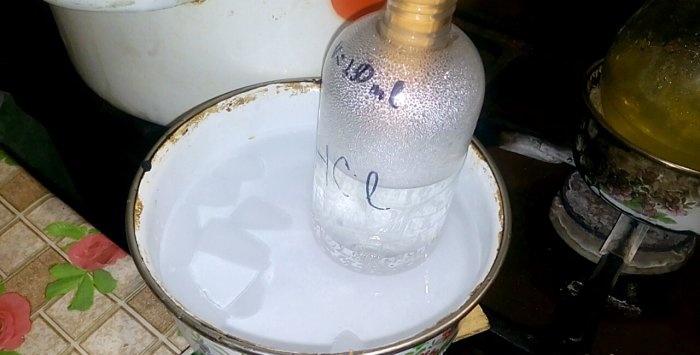Az alkimisták, akik először a sósavat kaptak a 15. században, spiritus salis-nak, „sóból származó szellemnek” hívták. Ennek a savnak varázslatos tulajdonságai voltak abban az időben: korrodálta a papírt, oldott fémeket, megmérgezte az embereket. Ezek a tulajdonságok a mai napig megmaradtak, de ezt a savat kellőképpen megvizsgálták, és itt nincs varázslat.
A sósav (HCl) erős egybázisú sav, tiszta formájában tiszta folyadék. A maximális 38% koncentrációnál „levegõz”. Olyan savat kapunk, amelynek koncentrációja fele.
Tehát kezdjük el.
Biztonsági óvintézkedések
Vigyázat, mérgező anyagokkal dolgozzon!
Minden kísérletet jól szellőző helyiségben vagy páraelszívó alatt kell elvégezni. Ügyeljen arra, hogy viseljen védőszemüveget (elérhető a boltban. Áruházban) és kesztyűt (ha nem talál speciális vegyi kesztyűt, jó minőségű mosogatáshoz).
A kísérlet helyén sütő szódanak kell lennie, hogy előre nem látható helyzetben semlegesítse a savat (szén-dioxid és víz szabadul fel).
Szigorúan tilos kísérletet végezni fémtartályokban.
Szüksége lesz
A kísérlet végrehajtásához a következőkre lesz szükség:
- Savas elektrolit akkumulátorokhoz (az autókereskedésben kapható);
- Desztillált víz (uo.);
- Só (bármilyen konyhában található);
- Sütő szóda (lásd a biztonsági óvintézkedéseket).
A szükséges ételek közül:
- Üveg izzó;
- Egy edény homokkal, ahova el lehet helyezni a lombikot;
- Több 200 ml-es eldobható csésze;
Hőálló izzóval rendelkezik, az égő nyílt lángja alatt melegítheti. De mégis javaslom homokon keresztül, ebben az esetben a sav felszívódik.
Szüksége lesz egy pár 50 mm átmérőjű vízvezeték-sarokra és egy égőre (az én esetemben alkoholra, de azt javaslom, hogy használjon gázt).
1. szakasz - párolgás
Az akkumulátor elektrolitja a legtöbb 36% kénsav (H2SO4). Először növelnünk kell a koncentrációját.
Öntsön 200 ml-t az üvegre, vagyis szinte a széleire, és öntse az üveg kicsit több mint felét a lombikba. Készítsen egy jelölőt egy jelölővel, és adja hozzá a többit.
A lombik körül fóliás reflektorot helyeztem a hatékonyabb melegítéshez, de később eltávolítottam, mert megolvadt.
Most tegyük a lombikot az égőre, és párologtatjuk a korábban beállított jel szintjére, még egy kicsit alacsonyabb szintre is.
Ezzel párhuzamosan a sarkon többször összehajtogatott gélt tetünk és rugalmas szalaggal rögzítjük. Készítünk telítetlen szódaoldatot, és belemerítjük a sarok végébe gézzel.
Amikor az elektrolit forrni kezd, egy sarkot helyezünk a lombikra, amely szorosan rá ül. A gézvég a nyitott ablakra kerül.
Erre akkor van szükség, ha a kénsav hirtelen maga elkezdi elpárologni a vízzel. Ha nem túlmelegíti a lombikot, akkor ez nem történik meg.
Égő működésben:
Az égőm teljesítménye viszonylag kicsi, így a párologtatás körülbelül egy órát vett igénybe. Gázégő vagy elektromos tűzhely nagyban felgyorsítaná ezt a folyamatot.
Az első szakasz befejezése után az oldat valamivel kevesebb, mint felének, azaz körülbelül 75% -os koncentrációjú savnak kell maradnia a lombikban. Ne felejtsük el a pontosságot.
Hagyja szobahőmérsékletre lehűlni.
2. szakasz - számítások
Most, amikor koncentrált kénsav van, elvégezhetjük a fő reakciót, az alábbiak szerint néz ki:
De először végezzünk néhány számítást, és végül összehasonlítsuk őket a gyakorlatban történt eseményekkel.
Tehát kezdetben 200 ml elektrolit volt, sűrűsége 1,27 g / cm3. A kénsav sűrűségi táblázata alapján láthatjuk, hogy ez a sűrűség 36% koncentrációnak felel meg. Számítsa ki a sav mennyiségét:
200ml * 36% = 72ml - V (H2SO4)
Miután bepároltuk az oldatot, annak koncentrációja és ennek megfelelően a sűrűsége megnőtt. Ugyanazt a táblázatot nézzük meg, és látjuk, hogy a 75% -os koncentráció 1,67 g / cm3 sűrűségnek felel meg.
Ismerve a sav jelenlegi sűrűségét (p) és térfogatát (V), megtudjuk a tömeget:
m = p * V;
m (H2SO4) = 1,67 g / cm3 * 72 ml = 120 g;
m (H2SO4) = 1,67 g / cm3 * 72 ml = 120 g;
Most az iskolai kémiából emlékeztetünk:
m (H2SO4) / M (H2SO4) = m (NaCl) / M (NaCl) = m (HCl) / M (HCl),
ahol M az anyag moláris tömege.
ahol M az anyag moláris tömege.
A H2SO4, NaCl és HCl móltömege 98, 58,5 és 36,5 g / mol. Most megtudhatja, mennyi só szükséges és mennyi só lesz.
Nevezetesen, szükségünk lesz 72 g NaCl-ra, ez 34 ml, tegyen be többet - egy negyed csésze.
Kiváló, és a sósav elméletileg 44,7 g lesz.
A sósavas sűrűség táblázatában g / l oszlop található. Innentől a 15% - 166,4 g / l koncentráció értékét vesszük. A 15% -os sósav előállításához szükséges vízmennyiség 44,7 / 166,4–270 ml. Fogunk venni 200ml. Ennek eredményeként elméletileg 22% sósavat kapok.
3. szakasz - sav előállítása
A következő sarkokat összekapcsoljuk:
És a teljes szerkezet így néz ki:
A megfelelő sav kondenzálódik a sósavval jelölt edénybe, a víz térfogata 200 ml. Jelölje meg ezen az edényen az aktuális folyadék szintjét.
Távolítsuk el a sarkokat és öntsük a tölcséren keresztül a lombikba a számításokban kiszámított sómennyiséget.
Az oldat sárgára vált.
Annak érdekében, hogy a sósav kiemelkedjen, be kell kapcsolnia az égőt. De először szorosan rögzítjük a sarkokat a lombikhoz és a befogadó edényhez.
A savkondenzáció során a vízben vertikális hullámok alakulnak ki. Ezenkívül az oldat felmelegszik, és lehűteni kell. Például letehet egy újabb edényt jéggel alulról.
A reakció viszonylag gyorsan megy végbe - 20 perc alatt, amely után kikapcsolhatja a tüzet. Az utolsó pár sósavat adjuk vízben való feloldódáshoz, majd szorosan bezárjuk az edényt. Amikor a lombik lehűlt, a maradék oldatot vízzel (körülbelül egy-egy) hígítjuk és öntsük a csatornába.
eredmény
Az edényen szereplő címke alapján meghatározzuk, mennyi folyadék került hozzá. Nekem van ⅙, azaz 17%. Ez a sósav koncentrációja. Hasonlítsa össze az elméletben kapott értékkel.
17% / 22% * 100% = 77% a reakció hozama.
Fontos megjegyezni, hogy nincs kiút 1-gyel, mindig veszteségek vannak. Az én esetemben ez nem elegendő az elpárologtatott elektrolit. Ideális esetben a kénsav koncentrációjának 90–95% -nak kell lennie.
Ellenőrizze a kapott sav kölcsönhatását a fémmel.
Megfigyeljük a hidrogén gyors fejlődését. Ez azt jelenti, hogy a sav alkalmas további kísérletekre.
variációk
Lombikként használhat tiszta üveg sört vagy szódat, de feltéve, hogy a melegítés a lehető legalacsonyabb. PVC sarok helyett polipropilén csöveket és kisebb átmérőjű sarkokat is vehet (a lombikhoz megfelelő).
Ismételten sürgetem, hogy tartsa be a biztonsági óvintézkedéseket. Sok szerencsét mindenkinek!