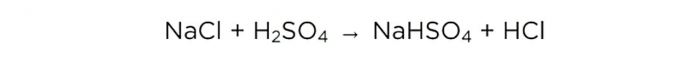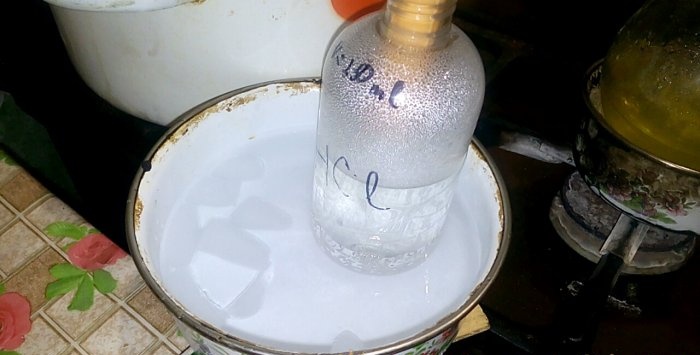Alchemisten, die im 15. Jahrhundert erstmals Salzsäure herstellten, nannten sie „Spiritus Salis“, „Geist aus Salz“. Diese Säure hatte damals magische Eigenschaften: Sie korrodierte Papier, löste Metalle und vergiftete Menschen. Diese Eigenschaften bleiben ihr bis heute erhalten, doch inzwischen ist diese Säure ausreichend erforscht und es gibt hier keine Magie mehr.
Salzsäure (HCl) ist eine starke einbasische Säure, in reiner Form ist sie eine transparente Flüssigkeit. Bei einer maximalen Konzentration von 38 % „raucht“ es an der Luft. Wir erhalten Säure mit einer Konzentration, die halb so hoch ist.
Also lasst uns anfangen.
Sicherheitstechnik
Seien Sie vorsichtig beim Umgang mit giftigen Substanzen!
Alle Experimente müssen in einem gut belüfteten Raum oder unter einer Abzugshaube durchgeführt werden. Tragen Sie unbedingt eine Schutzbrille (im Baumarkt erhältlich) und Handschuhe (wenn Sie keine speziellen Chemikalienhandschuhe finden, sind solche von guter Qualität geeignet). zum Geschirrspülen).
Am Ort des Experiments muss Backpulver vorhanden sein, um die Säure in einer unvorhergesehenen Situation zu neutralisieren (dadurch werden Kohlendioxid und Wasser freigesetzt).
Es ist strengstens verboten, Experimente in Metallbehältern durchzuführen.
Wird benötigt
Um das Experiment durchzuführen, benötigen wir:
- Säureelektrolyt für Batterien (im Autohaus erhältlich);
- Destilliertes Wasser (ebd.);
- Speisesalz (in jeder Küche erhältlich);
- Backpulver (siehe Sicherheitshinweise).
Von den Gerichten benötigen Sie:
- Glasflasche;
- Ein Gefäß mit Sand, in das Sie die Flasche stellen können;
- Mehrere Einwegbecher 200 ml;
Wenn Sie eine hitzebeständige Flasche haben, können Sie diese unter der offenen Flamme eines Brenners erhitzen. Ich empfehle jedoch weiterhin die Verwendung von Sand, da dieser dann Säure aufnimmt.
Sie benötigen außerdem ein Paar Installationswinkel mit einem Durchmesser von 50 mm und einen Brenner (in meinem Fall Alkohol, ich empfehle jedoch die Verwendung eines Gasbrenners).
Stufe 1 – Verdunstung
Der Elektrolyt für Batterien ist 36 %ige Schwefelsäure (H2SO4). Zuerst müssen wir seine Konzentration erhöhen.
Gießen Sie 200 ml in das Glas, also fast bis zum Rand, und gießen Sie etwas mehr als die Hälfte des Glases in den Kolben. Machen Sie eine Markierung mit einem Marker und fügen Sie den Rest hinzu.
Für eine effizientere Erwärmung habe ich einen Folienreflektor um den Kolben gelegt, ihn aber später entfernt, weil er zu schmelzen begann.
Stellen Sie nun den Kolben auf den Brenner und verdampfen Sie bis zur zuvor eingestellten Markierung, sogar etwas darunter.
Gleichzeitig legen wir mehrfach gefaltete Gaze an die Ecke und befestigen sie mit einem Gummiband. Bereiten Sie eine ungesättigte Sodalösung vor und tauchen Sie das Ende der Ecke mit Gaze hinein.
Wenn der Elektrolyt zu kochen beginnt, legen wir eine Ecke auf den Kolben, er sitzt fest darauf. Wir richten das Gazeende in das offene Fenster.
Dies ist notwendig, wenn plötzlich die Schwefelsäure selbst zusammen mit dem Wasser zu verdampfen beginnt. Wenn Sie den Kolben nicht zu stark erhitzen, wird dies nicht passieren.
Brenner in Aktion:
Mein Brenner hat eine relativ geringe Leistung, daher dauerte die Verdampfung etwa eine Stunde.Ein Gasbrenner oder Elektroherd würde diesen Vorgang deutlich beschleunigen.
Nach Abschluss der ersten Stufe sollte etwas weniger als die Hälfte der Lösung im Kolben verbleiben, also eine Säure mit einer Konzentration von etwa 75 %. Vergessen Sie nicht die Genauigkeit.
Auf Raumtemperatur abkühlen lassen.
Stufe 2 – Berechnungen
Nachdem wir nun konzentrierte Schwefelsäure haben, können wir die Grundreaktion durchführen, sie sieht so aus:
Aber lassen Sie uns zunächst einige Berechnungen durchführen und diese am Ende mit der Praxis vergleichen.
Wir hatten also zunächst 200 ml Elektrolyt mit einer Dichte von 1,27 g/cm³. Wenn wir uns die Dichtetabelle der Schwefelsäure ansehen, sehen wir, dass diese Dichte einer Konzentration von 36 % entspricht. Berechnen wir das Säurevolumen:
200 ml*36 %=72 ml – V(H2SO4)
Nachdem wir die Lösung eingedampft hatten, nahm ihre Konzentration und damit ihre Dichte zu. Wir schauen uns die gleiche Tabelle an und sehen, dass eine Konzentration von 75 % einer Dichte von 1,67 g/cm³ entspricht.
Wenn wir die Stromdichte (p) und das Volumen (V) der Säure kennen, ermitteln wir die Masse:
m=p*V;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
m(H2SO4)=1,67g/cm³ * 72ml=120g;
Jetzt erinnern wir uns aus der Schulchemie:
m(H2SO4)/M(H2SO4)=m(NaCl)/M(NaCl)=m(HCl)/M(HCl),
wobei M die Molmasse der Substanz ist.
wobei M die Molmasse der Substanz ist.
Die Molmassen von H2SO4, NaCl und HCl betragen 98, 58,5 bzw. 36,5 g/mol. Jetzt können wir herausfinden, wie viel Speisesalz benötigt wird und wie viel HCl wir bekommen.
Wir brauchen nämlich 72 g NaCl, das sind 34 ml, nehmen wir es im Überschuss – ein viertel Glas.
Großartig, und theoretisch ergibt sich eine HCl-Menge von 44,7 g.
Die HCl-Dichtetabelle verfügt über eine g/l-Spalte. Wir nehmen daraus den Wert für eine Konzentration von 15 % – 166,4 g/l. Das zur Gewinnung von 15 % HCl erforderliche Wasservolumen beträgt 44,7/166,4≈270 ml. Wir nehmen 200 ml. Als Ergebnis erhalte ich theoretisch 22 %ige Salzsäure.
Stufe 3 – Säuregewinnung
Wir verbinden die beiden Ecken wie folgt:
Und die gesamte Struktur wird so aussehen:
Die entsprechende Säure kondensiert in einem Gefäß mit der Aufschrift HCl; das Wasservolumen darin beträgt 200 ml. Markieren Sie auf diesem Behälter auch den aktuellen Flüssigkeitsstand.
Wir entfernen die Ecken und gießen die berechnete Menge Salz durch einen Trichter in die Flasche.
Die Lösung wird gelb.
Damit Salzsäure freigesetzt wird, müssen Sie den Brenner einschalten. Aber zuerst befestigen wir die Ecken fest am Kolben und am Auffanggefäß.
Wenn Säure in Wasser kondensiert, entstehen „vertikale Wellen“. Außerdem erwärmt sich die Lösung und muss abgekühlt werden. Sie können beispielsweise ein weiteres Gefäß mit Eis darunter platzieren.
Die Reaktion verläuft relativ schnell – 20 Minuten, danach können Sie die Hitze ausschalten. Lassen Sie die letzten Dämpfe der Salzsäure im Wasser auflösen und verschließen Sie das Gefäß dann hermetisch. Wenn der Kolben abgekühlt ist, verdünnen Sie die restliche Lösung mit Wasser (ungefähr eins zu eins) und gießen Sie sie in die Kanalisation.
Endeffekt
Anhand der Markierung auf dem Gefäß ermitteln wir, wie viel Flüssigkeit hinzugefügt wurde. Bei mir sind es ⅙, also 17 %. Dies ist die Konzentration unserer Salzsäure. Vergleichen wir es mit dem theoretisch erhaltenen.
17 %/22 %*100 %=77 % – Reaktionsausbeute.
Es ist wichtig zu beachten, dass es keinen Ausgang gleich 1 gibt, es gibt immer Verluste. In meinem Fall handelt es sich um einen unzureichend verdampften Elektrolyten. Idealerweise sollte die Konzentration der Schwefelsäure 90-95 % betragen.
Lassen Sie uns die resultierende Säure auf Wechselwirkung mit Metall prüfen.
Wir beobachten eine schnelle Entwicklung von Wasserstoff. Damit ist die Säure für weitere Experimente geeignet.
Variationen
Als Kolben können Sie eine saubere Glasflasche Bier oder Limonade verwenden, allerdings unter der Voraussetzung, dass die Erhitzung möglichst gleichmäßig erfolgt. Anstelle von PVC-Ecken können Sie Polypropylenrohre und Ecken mit kleinerem Durchmesser (passend für Ihre Flasche) verwenden.
Ich bitte Sie noch einmal dringend, die Sicherheitsvorkehrungen zu beachten. Allen frohe Erlebnisse!