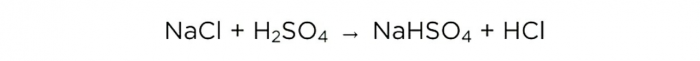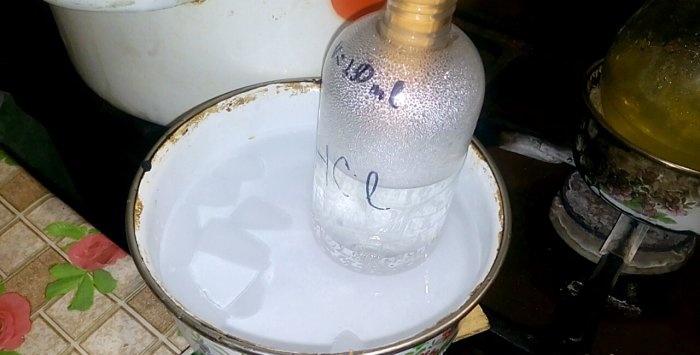Алхимиците, които за първи път са получили солна киселина през XV век, я наричат „spiritus salis“, „дух от сол“. Тази киселина е имала магически свойства по това време: корозира хартия, разтваря метали, отрови хора. Тези свойства са останали с нея и до днес, но сега тази киселина е достатъчно проучена и тук няма магия.
Солна киселина (HCl) е силна моноосновна киселина, в чистата й форма е бистра течност. При максималната си концентрация от 38% „пуши“ във въздуха. Ще получим киселина с концентрация наполовина.
Така че нека започнем.
Предпазни мерки за безопасност
Внимание, работете с токсични вещества!
Всички експерименти трябва да се извършват в добре проветриво помещение или под капак. Не забравяйте да носите предпазни очила (налични в магазина. Магазин) и ръкавици (ако не намерите специални химически ръкавици, те са с добро качество за миене на съдове).
На мястото на експеримента трябва да присъства сода за хляб, за да се неутрализира киселина в непредвидена ситуация (ще се отделят въглероден диоксид и вода).
Категорично е забранено провеждането на експеримент в метални контейнери.
Ще има нужда
За провеждането на експеримента ще ни трябва:
- Киселен електролит за батерии (продава се в магазина за автомобили);
- Дестилирана вода (пак там);
- Сол (има във всяка кухня);
- Сода за хляб (вижте предпазните мерки за безопасност).
От чиниите, от които се нуждаете:
- Стъклена колба;
- Съд с пясък, където можете да поставите колбата;
- Няколко чаши за еднократна употреба от 200 ml;
Ако имате термоустойчива крушка, можете да я нагреете под открития пламък на горелката. Но все пак го препоръчвам чрез пясък, като в този случай той абсорбира киселина.
Ще ви трябват и чифт водопроводни ъгли с диаметър 50 мм и горелка (в моя случай алкохол, но препоръчвам да използвате газов).
Етап 1 - изпаряване
Електролитът на акумулатора е най-много 36% сярна киселина (H2SO4). Първо, трябва да увеличим концентрацията му.
Изсипете 200 мл в чашата, тоест почти до краищата и изсипете малко повече от половината чаша в колбата. Направете маркер с маркер и добавете останалото.
Сложих рефлектор с фолио около колбата за по-ефективно загряване, но по-късно го отстраних, защото започна да се топи.
Сега поставяме колбата върху горелката и изпаряваме до нивото на предварително зададената маркировка, дори малко по-ниска.
Успоредно с това поставяме марля, сгъната няколко пъти над ъгъла и я фиксираме с еластична лента. Приготвяме ненаситен разтвор на сода и потапяме в него края на ъгъла с марля.
Когато електролитът започне да кипи, поставяме ъгъл на колбата, тя седи плътно върху нея. Краят на марлята се изпраща до отворения прозорец.
Това е необходимо, ако изведнъж самата сярна киселина започне да се изпарява с вода. Ако не прегреете колбата много, това няма да се случи.
Горелка в действие:
Мощността на горелката ми е сравнително малка, така че изпарението отне около час. Газова горелка или електрическа печка значително биха ускорили този процес.
След приключване на първия етап в колбата трябва да остане малко по-малко от половината от разтвора, тоест киселина с концентрация около 75%. Не забравяйте за точността.
Оставете да се охлади до стайна температура.
Етап 2 - изчисления
Сега, когато сме концентрирали сярна киселина, можем да проведем основната реакция, изглежда по следния начин:
Но първо, нека направим някои изчисления и накрая ги сравняваме с случилото се на практика.
И така, първоначално имахме 200ml електролит с плътност 1,27 g / cm³. Разглеждайки таблицата на плътността на сярна киселина, виждаме, че тази плътност съответства на концентрация от 36%. Изчислете обема на киселината:
200ml * 36% = 72ml - V (H2SO4)
След като изпаряваме разтвора, концентрацията му и съответно плътността се увеличава. Поглеждаме към същата таблица и виждаме, че концентрация от 75% съответства на плътност 1,67 g / cm³.
Знаейки плътността на тока (p) и обема (V) на киселината, откриваме масата:
m = p * V;
m (H2SO4) = 1,67 g / cm³ * 72ml = 120 g;
m (H2SO4) = 1,67 g / cm³ * 72ml = 120 g;
Сега от училищната химия си припомняме:
m (H2SO4) / M (H2SO4) = m (NaCl) / M (NaCl) = m (HCl) / M (HCl),
където M е моларната маса на веществото.
където M е моларната маса на веществото.
Моларните маси на H2SO4, NaCl и HCl са съответно 98, 58.5 и 36.5 g / mol. Сега можем да разберем колко сол е необходима и колко HCl ще бъде.
А именно, ще ни трябват 72 г NaCl, това е 34 мл, приемете в излишък - четвърт чаша.
Отличен, а HCl на теория ще бъде 44,7 g.
В таблицата за плътност на HCl има g / l колона. От там вземаме стойността за концентрация 15% - 166.4 g / l. Обемът на водата, необходима за получаване на 15% НС1, е 44,7 / 166,4≈270 мл. Ще вземем 200мл. В резултат на теория ще получа 22% солна киселина.
Етап 3 - получаване на киселина
Свързваме двата ъгъла, както следва:
И цялата структура ще изглежда така:
Съответната киселина ще се кондензира в съда с етикет HCl, обемът на водата в него е 200ml. Също така маркирайте текущото ниво на течност на този съд.
Изваждаме ъглите и изсипваме изчисленото при изчисленията количество сол в колбата през фунията.
Разтворът става жълт.
За да започне да се откроява солна киселина, трябва да включите горелката. Но първо, плътно прикрепяме ъглите към колбата и приемащия съд.
С кондензацията на киселина във вода се образуват "вертикални вълни". Също така разтворът се загрява и трябва да се охлади. Например, можете да поставите друг съд с лед отдолу.
Реакцията протича сравнително бързо - 20 минути, след което можете да изключите огъня. Даваме последните двойки солна киселина да се разтварят във вода, след което плътно затваряме съда. Когато колбата се охлади, разреждаме там останалия разтвор с вода (около един до един) и я изсипваме в канализацията.
резултат
По етикета на съда определяме колко течност е добавена. Имам го ⅙, това е 17%. Това е концентрацията на солната ни киселина. Сравнете го с получения на теория.
17% / 22% * 100% = 77% е реакционният добив.
Важно е да се отбележи, че няма изход, равен на 1, винаги има загуби. В моя случай това не е достатъчно изпарен електролит. В идеалния случай концентрацията на сярна киселина трябва да бъде 90-95%.
Проверете получената киселина за взаимодействие с метала.
Наблюдаваме бързото отделяне на водород. Това означава, че киселината е подходяща за допълнителни експерименти.
вариации
Като колба можете да използвате чиста стъклена бутилка бира или сода, но при условие че отоплението е възможно най-гладко. Вместо PVC ъгли можете да вземете полипропиленови тръби и ъгли с по-малък диаметър (подходящ за вашата колба).
Още веднъж ви призовавам да спазвате мерките за безопасност. Успех на всички!